はじめに
ヒトの脳は約1,400 gの臓器であり、私たちの「こころ」と「からだ」をコントロールしています。脳の重量は体重の約2%であり、頭蓋の中に納まるほどコンパクトな臓器ですが、万物の中でもっとも複雑なシステムといえます。この脳のはたらきを解明するのが「神経科学」です。これまでに多くの研究者が脳の謎に取り組み、その複雑で「柔軟な」機能が少しずつ明らかになってきています。脳は母体内での発生過程のみならず、成長・成熟過程でダイナミックに変化し続け、ヒトの高次な脳機能発現を可能にしますが、一方でそのシステムは疾患と密接にリンクしていることが示されつつあります。
統合失調症(Schizophrenia)や自閉スペクトラム症(Autism Spectrum Disorder; ASD)などの精神疾患は有病率が高く、根本的な治療法がなく、多くの患者さんがその症状と社会不適応に悩んでいます。これらの疾患の背景には神経回路の発生・発達の異常が存在し、遺伝的要因と環境要因との複合的な組み合わせによってもたらされます。私たちの研究室では、精神疾患の病態を分子のミクロなレベルから脳の形態形成のマクロレベルまで明らかにし、治療法や予防法へと繋げることを目指しています。
1.シナプス機能を支える細胞内輸送機構
中枢神経シナプスに発現する神経伝達物質受容体には、興奮性神経伝達に関わるNMDA受容体やAMPA受容体、抑制性神経伝達に関わるGABA受容体など多数が知られています(図1)。これらの受容体は、神経伝達の調節・神経可塑性の発現など、重要な神経機能を担っています。
これらの受容体は細胞体などで生合成された後、特異的輸送システムによって樹状突起を経てシナプス領域へ運ばれ、集積します。その輸送システムは、
- 樹状突起内部の微小管依存性輸送(キネシン関連蛋白による)
- 微小管からアクチン線維への乗り換え
- アクチン線維依存性輸送(ミオシン関連蛋白による)
の3段階からなります(図2)。このような受容体輸送は、いつも一定のレートで一定の荷物を運んでいるわけではなく、神経細胞の活動の変化や外界の刺激により、ダイナミックに変化します。輸送の制御がどのような分子メカニズムにより行われるのか、また動物のどのような脳機能を支えているのかを解明することを目標にしています。
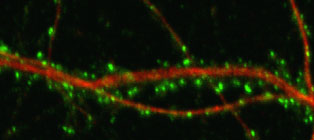
図1.初代培養神経細胞の樹状突起をレーザー共焦点顕微鏡で撮影した像。樹状突起(MAP2 = 赤)の周りにNMDA受容体(緑)が局在していることを示している。
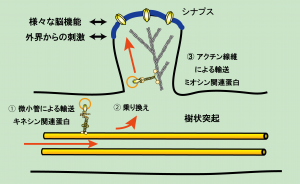
図2.神経細胞における細胞内輸送システム(図をクリックすると拡大します)
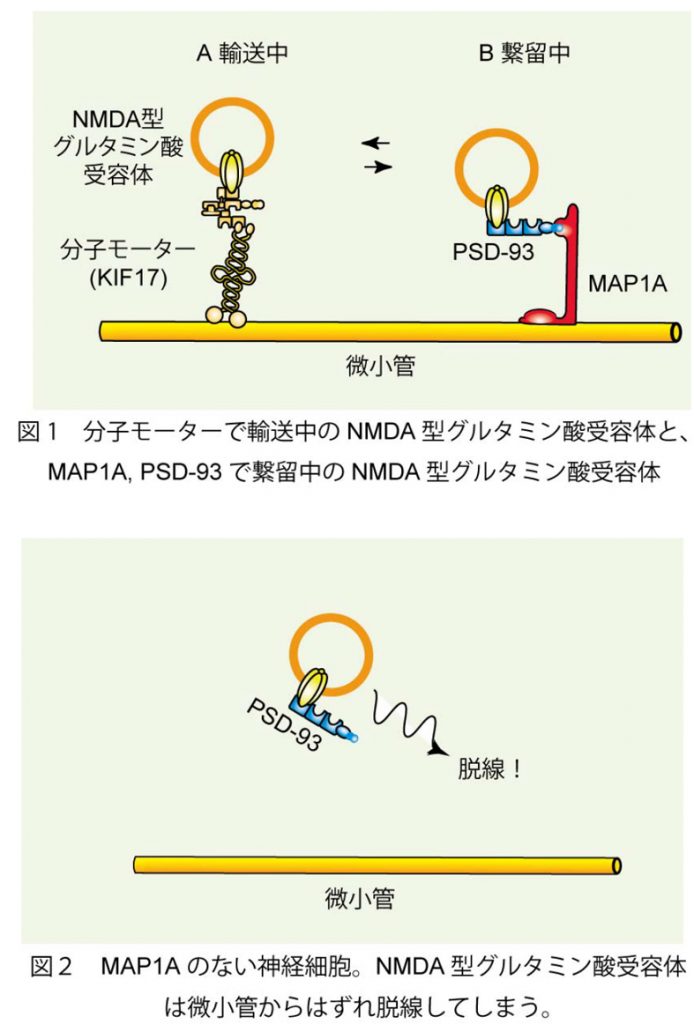
2.NMDA 型グルタミン酸受容体輸送の脱線防止機構の解明
NMDA型グルタミン酸受容体は、グルタミン酸に結合してはたらく受容体であり、動物の記憶や学習に深くかかわりを持つことが知られています。脳のなかで記憶がつくられるためには、このNMDA型グルタミン酸受容体があらかじめシナプスに輸送されて集められている必要があります。私たちの研究室では、東京大学の廣川信隆先生の研究室と協力して、MAP1A という分子が、シナプスへ輸送される途中の NMDA 型グルタミン酸受容体を微小管につなぎ、安定化することでレールからの『脱線』を防ぎ、輸送の効率化と安定性の向上に役立っていることをつきとめました。MAP1A を欠いたマウスの神経細胞では、NMDA 型グルタミン酸受容体がシナプスヘうまく運ばれず、その結果としてマウスの記憶能力は著しく損なわれていました。MAP1Aは人間の脳にも存在します。記憶や学習のような重要な脳の機能がどのように支えられているのか理解するための新しい鍵になるとともに、認知症や統合失調症などNMDA型グルタミン酸受容体機能とかかわりの深い精神神経疾患の治療法の開発への貢献が期待されます。
3.神経細胞内の記憶の書き換え機構の解明
神経細胞内における記憶の書き換えメカニズムの解明は、心的外傷後ストレス障害(PTSD)を代表とする記憶障害を伴った精神疾患の治療開発において重要な役割を担っていますが、実際に神経細胞がどのように記憶の書き換えや恐怖記憶の消去を行っているかについては現在十分には理解されていません。私たちは、キネシン分子モーターKIF17による受容体輸送が神経活動を契機としてKIF17の分解により一時的に廃止され、その後すぐに樹状突起内において再開されるということを発見しました。この分子機構は必要物資を細胞体から遠位の神経突起内へと輸送するという従来の分子モーターの役割とは異なり、神経活動を契機として突起内の受容体の位置を分子モーターが制御すると考えられ、樹状突起内に輸送の起点と終点が存在する新しいメカニズムです。このKIF17による分子機構が正常に働かないマウスを開発したところ、恐怖記憶がほとんど消去できないPTSD様の症状を示しました。分子モーターによる受容体位置制御を基盤とした1つの樹状突起での記憶の書き換えメカニズムが本研究により解明されたことは、記憶の書き換え障害が関与するPTSD等の精神疾患治療に新たな戦略をもたらすものです。
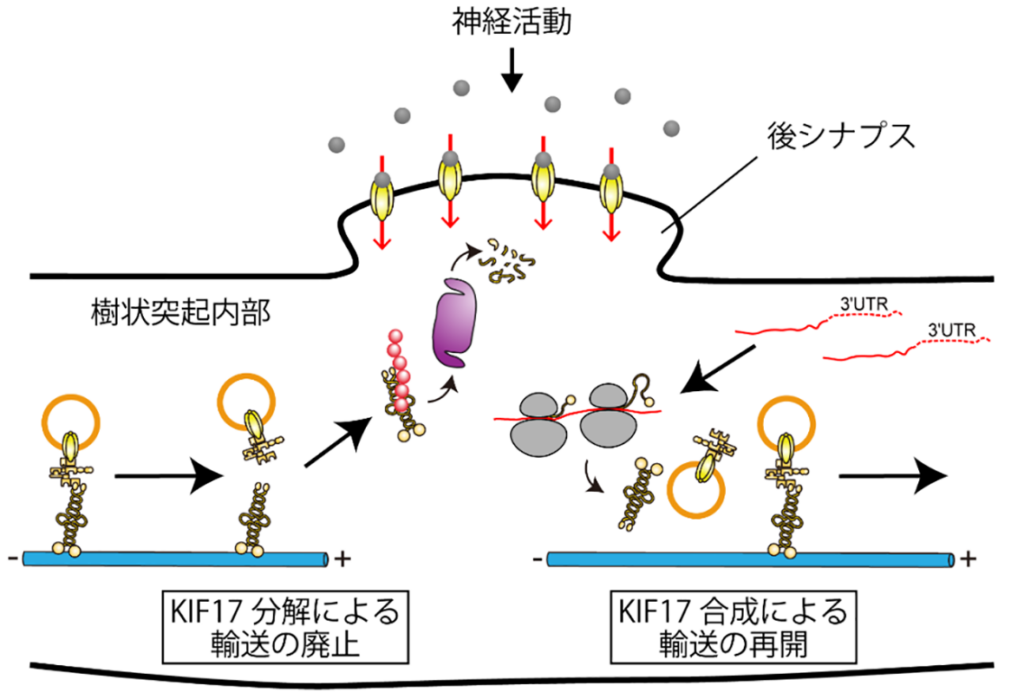
図1. 神経活動を契機にKIF17が分解されてNR2Bの輸送が廃止されるが、直後から樹状突起内にあるmRNAからKIF17タンパク質が合成され、輸送が再開する。
4. 神経突起内輸送動態を検知する光波散乱を用いた高速3次元解析システムの開発
神経細胞の機能と可塑性を深く理解するためには、神経細胞の形態をより高分解能かつ高速に検出することが必要です。私たちの研究室では、 光波散乱計測scatterometryを用いています。光波散乱計測は、特に物体が単純な形状で、吸収と散乱の影響が大きい場合に有効です。この方法では、空間分解能を
ミリ秒以下の時間分解能での測定が可能であり、さらに、非破壊・非接触で、蛍光標識も不要です。
光学計算技術の進歩により、神経細胞の形態に関連する屈折率分布の厳密な計算が高速化され、細胞の形状や大きさを客観的かつ定量的に解析できるようになりつつあります。
5.精神疾患モデル動物の開発
統合失調症や自閉症等の精神神経疾患には、根本的な治療法がありません。そのため、病気である本人だけではなく、家族など周囲の人々も長期にわたり苦しまねばなりません。これらの疾患の原因のひとつに、シナプスの機能異常があることが少しづつわかってきていますが、詳しいことはまだ不明なままです。当研究室では、精神神経疾患の原因解明、診断法・治療法の開発の手がかりを掴むことを目標に、以下のふたつのアプローチで上記疾患の動物モデルを開発しています。これらの研究は、革新的技術による脳機能ネットワークの全容解明プロジェクト (Brain/MINDS)の一貫として行われています。
(1)細胞内輸送異常モデル
細胞内輸送は、正常なシナプス機能を支えるだけではありません。シナプスの機能異常が統合失調症などの精神神経疾患の原因となっており、その背景に細胞内輸送の故障が存在する例がいくつもみつかってきています。当研究室は、こうした脳の病気の分子メカニズムに注目し、マウス分子遺伝学を利用して精神神経疾患モデル動物を作成しています。
記憶の定着や忘却に関係するタンパク質の一つが、神経細胞の樹状突起にあり、シナプスの入力側である「スパイン」で発現するNMDA型グルタミン酸受容体(NMDAR)です。NMDARからCa2+が流入すると、流入量に応じて、スパインが拡大し長期増強(LTP)とよばれるシナプス結合の強化が起きたり、スパインが縮小して長期抑圧(LTD)が生じたりします。
LTPやLTDに関わるNMDARは、NR1とNR2のヘテロ2量体2セットから構成されています。さらにNR2サブユニットには4種類あり、その中でも特にNR2AはCa2+透過能が小さく、NR2BはCa2+透過能が大きいという特徴があります。NR2AとNR2Bの比率によってCa2+流入量がスパインごとに変わり、LTPとLTDのどちらが起きやすいかに関わると考えられます。
NR2AとNR2Bは神経細胞内で、キネシン分子モーターであるKIFによって運ばれています。さらに、ヒトの統合失調症患者の中には、KIF遺伝子に変異をもつ人がいることがわかっています。KIFがNR2AとNR2Bを細胞内で輸送するしくみを明らかにすることで、統合失調症の原因や、ひいては脳の機能の解明につながると考えています。私たちは、KIFに変異をもつマウスを用いて、神経細胞内の分子機序と、KIF変異が個体の行動にどう影響を及ぼすかについて研究を続けています。
私たちは、NR2A/NR2Bの「比率」を保つための何らかの機序があると仮説を立て、検証を行なっています。その比率を維持することが、適切なCa2+透過量につながり、適切なLTPやLTDを引き起こすのに必要だからです。そして、その比率が破綻したときに統合失調症につながるのではないかと考えています。
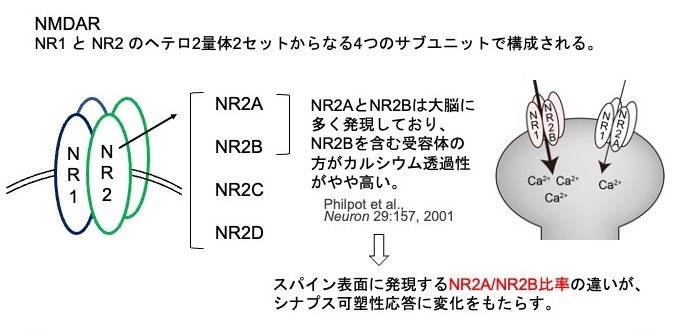
図1.NMDARはNR1とNR2のヘテロ2量体2セットからなる4つのサブユニットから構成され、Ca2+透過性が高いNR2Bの割合が多いと長期増強(LTP)が生じやすい。
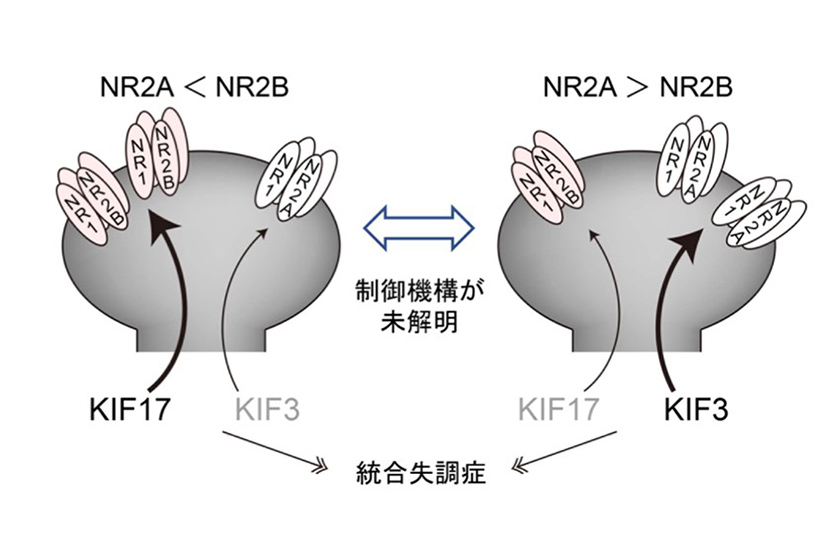
図2. KIF17はNR2Bを輸送し、KIF3はNR2Aを輸送する。しかし、NR2A/NR2Bの比率を保つ制御機構は不明で、この制御機構が破綻すると統合失調症につながるのではないかと考えられる。
(2)母体感染モデル
妊婦がインフルエンザなどのウィルスに感染すると、出生した子供の精神疾患発症リスクが高まることが多くの調査から明らかになっています。これは、母体免疫反応の活性化(maternal immune activation; MIA)が胎児の脳の発達や機能に影響し、出生後も長期にわたって影響を与えることを示唆しています。この知見をもとに、妊娠動物に特殊な免疫反応を引き起こす薬物を投与し、精神神経疾患モデル動物作出を行っています。モデル動物の解析によって、免疫反応の異常から神経機能の破綻にいたる分子病理メカニズムを解明し、治療法や予防法を開発につなげることを目標に研究をしています。
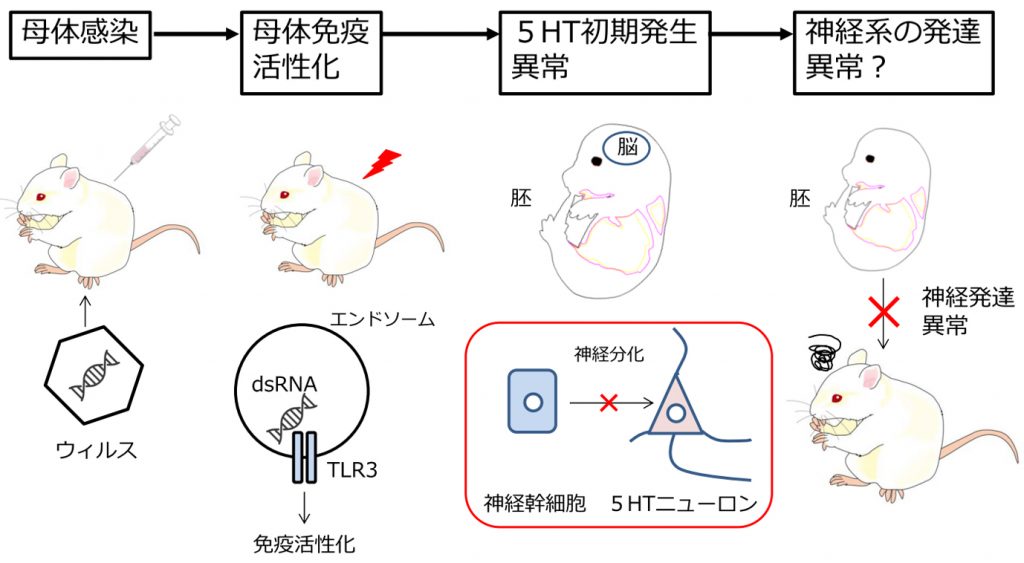
図3.母体免疫活性化によるセロトニン神経系発達異常の模式図 1)母体にウィルスが感染する。またはウィルスを模した物質を注射する。2)母体の免疫システムの活性化が起こる。3)免疫活性化により胎仔脳のセロトニン神経系発生異常が生じる。4)胎仔期のセロトニン神経系の発生異常により生後の神経系発達異常をきたす。
6.ASD関連遺伝子Myosin Idの解析
自閉スペクトラム症は社会的コミュニケーション障害および常同行動で特徴づけられる障害です。アメリカCDCのレポートでは有病率は1%以上と推定されており対策が急務です。近年,脳におけるシナプス異常がASDの病態に関与しているという証拠が蓄積されています。ASDリスク遺伝子の多くがシナプス関連分子であることがわかってきています。Stone et al.(2007)の遺伝子連鎖解析研究により,ミオシンIdがASDリスク遺伝子の候補に挙げられています。ミオシン(Myosin)とは細胞骨格アクチンフィラメントと結合するモータータンパク質です。ミオシンIdは神経での発現が確認されているにも関わらず,これまでニューロンでの局在や機能は明らかになっていませんでした。当研究室ではミオシンIdの神経細胞における局在を調べ,ミオシンIdのASD病態発生への関与の可能性を検討しています。これまでの研究の結果、神経細胞においてミオシンIdはアクチンと共局在し,神経突起及びスパインに集積することが明らかになっています。様々なアクチン結合タンパクがシナプス可塑性の基盤であるスパイン形態形成に寄与している(Hotulainen & Hoogenraad, 2010)ことから、ミオシンIdがスパインの形態形成やシナプス伝達に関与している可能性があるのではないかと考えられます。
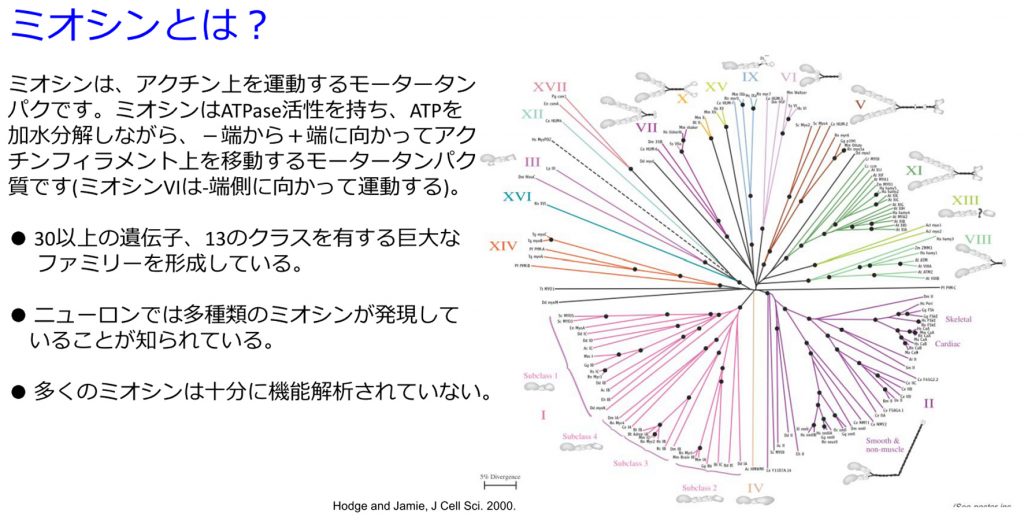
図3.ミオシンスーパーファミリー. ミオシンはアクチン上を運動するモータータンパクである。ミオシンはATPase活性を持ちATPを加水分解しながら、-端から+端に向かってアクチンフィラメント上を移動する。
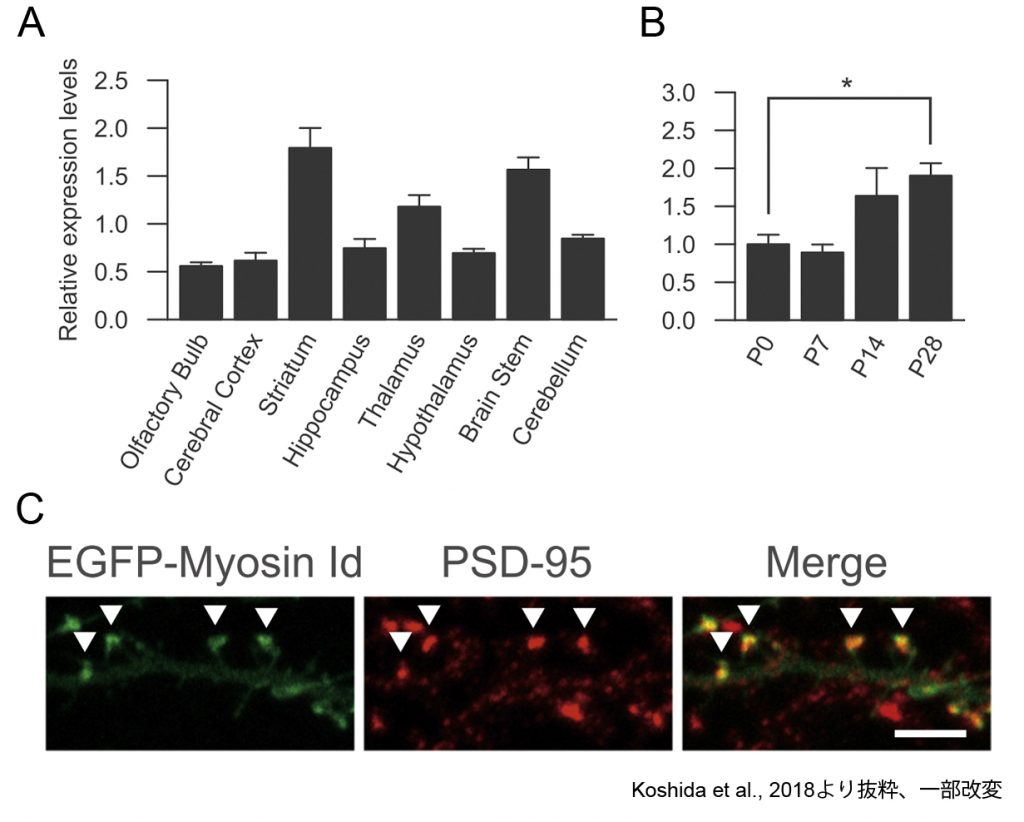
図4.ミオシンIdの解析. A. 8週齢マウス脳各部位におけるミオシンId mRNAの発現. B. 生後発達期のミオシンIdの発現変化. C. 培養海馬神経細胞におけるミオシンIdの局在解析. ミオシン Idは樹状突起スパインに集積している.
7.母体の免疫活性化による胎仔の大脳皮質形成への影響
これまで、脳はその重要な役割や、脳と他の器官を分離する血液脳関門(BBB)の特性から、ミクログリアという特定の免疫細胞を除いて、ほとんど免疫細胞が存在しないと考えられていました。しかし、最近の研究により、脳内に存在しないと考えられてきたリンパ管(免疫細胞の通路)の存在が明らかになりました。また単一細胞レベルの解析技術によって、通常の成体の脳内にもさまざまな免疫細胞が存在することがわかりました。これにより、脳内の免疫細胞が脳の正常な機能を維持するのに寄与している可能性が示唆されています。
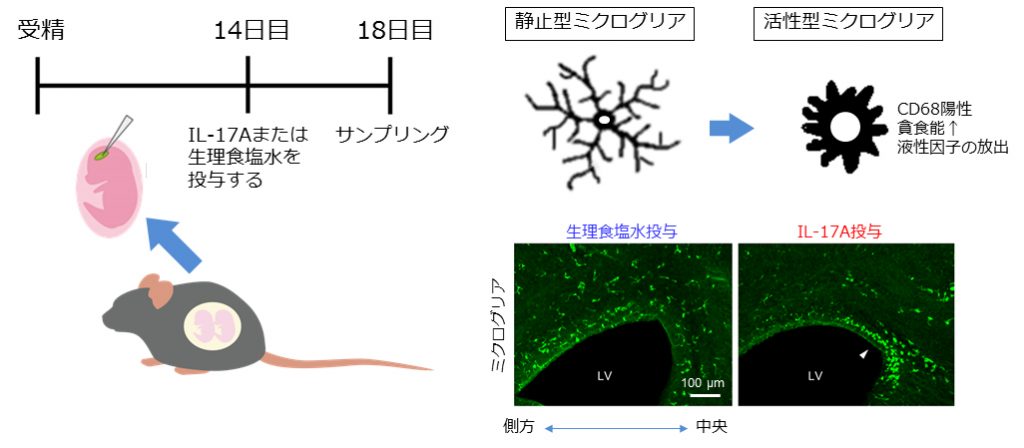
妊娠中のウイルス感染が胎児のASD発症リスクを上昇させることが、ヒトの疫学調査で報告されています。母体免疫システムの活性化により誘導された免疫分子が胎盤を通過し、胎児の脳がそれらにさらされ、ASD病態が生じると考えられます。近年、ウイルス感染時にTh17細胞が産生する炎症性サイトカインであるインターロイキン17AがASD発症の責任分子であることが示唆されていましたが、その詳細な作用は不明のままでした。
私たちはIL-17Aをマウス脳室内に直接投与し、大脳皮質形態形成への影響を調査しています。これまでにIL-17Aによりミクログリアが活性化した状態になっており脳室側に寄って分布していること、さらに大脳壁(将来の大脳皮質)の正中線付近に偏った状態になっていることを見出しています。将来、ミクログリアを標的としたASD治療薬の開発や、自己免疫疾患治療薬とし確立しているIL-17A抗体など既存薬物のASD予防・治療への応用が期待されます。
8.妊娠期Interleukin過剰による流産率への影響
母体免疫活性化を軸として新しい精神疾患モデル動物の確立を目指す中で、流産率に関する新しい表現型を見出しました。インターロイキン過剰発現マウスにおいて胎盤構造の脆弱性があり、さらに合成二本鎖RNA poly(I:C)の投与によって引き起こされる流産率を野生型と比較したところ、poly(I:C)投与によって引き起こされる流産率が野生型マウスに比べ顕著に高いことがわかりました。コントロールとしてPBSを投与した場合は、野生型マウスとインターロイキン過剰発現マウスの間に流産率の差は認めらていません。インターロイキン過剰発現が妊娠期マウスにおけるウイルス応答性を増強している可能性が示唆されています。
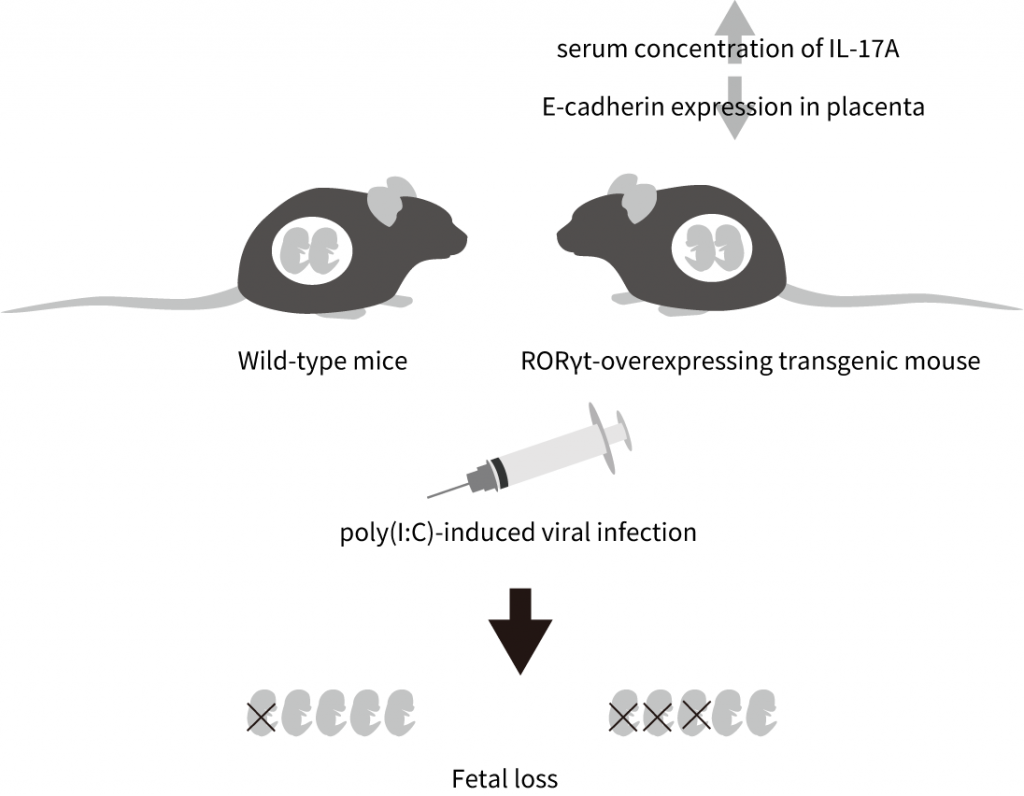
図5. RORγt過剰発現マウスにおけるpoly(I:C)誘導性流産率の上昇. RORγt過剰発現マウスでは、野生型と比較して血中のIL-17の濃度が高く、胎盤の上皮接着の脆弱性が認められる。poly(I:C)投与によって引き起こされる流産率が野生型マウスに比べ顕著に高いことがわかった(當銘, 佐々木, 高橋, 武井. 2019. )。
8. グリア細胞の形態変化に伴う細胞骨格再編成機構の解析
精神疾患や神経変性疾患患者の中枢神経系のアストロサイトやミクログリアは、通常とは異なる形態や性質を示すことが報告されています。グリア細胞の形態変化を制御する因子や細胞骨格・分子モーター関連分子の再編成機構の分子基盤にアプローチしています。
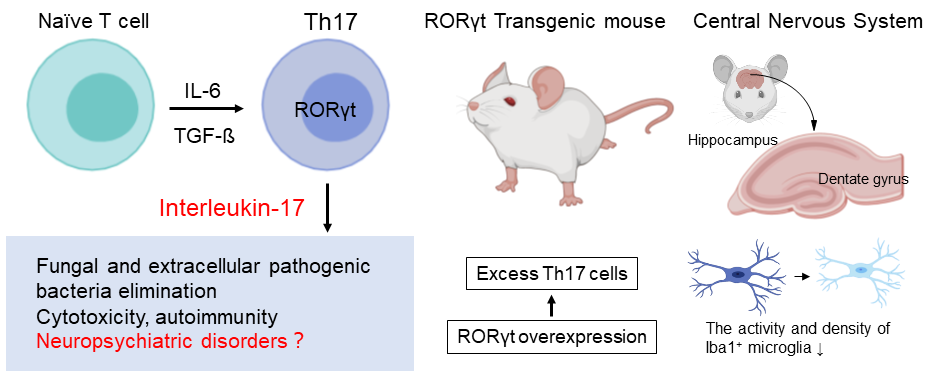
9.血清中のInterleukin過剰による中枢神経系への影響
ヘルパーT細胞サブセットであるTh17細胞による免疫反応は、精神・神経系疾患の病態生理に関与することが多くの臨床的研究から示されています。これらの疾患では中枢神経系の構造異常がみられますが、Th17細胞とIL-17Aの寄与については不明です。本研究では、血清中のIL-17A濃度が恒常的高値を示す遺伝子改変動物RORγtトランスジェニックマウスの脳の解析を行い、海馬歯状回でミクログリア活性状態の低下と密度の減少を見出しました。本研究結果は、精神・神経系疾患の病態生理における本分子の役割を理解する重要な手がかりをもたらすと考えられます。
10. 大脳皮質領野の形成とシナプス発達の解析
ヒトを含む霊長類では大脳皮質が発達しており、「領野」の機能分化が進んでいます。霊長類の機能的領野形成・成熟には、生後長期間継続する神経回路の再編成が重要です。これは複雑な社会環境に適応する基盤を与えるとともに、脳機能発達の「歪み」が生じやすい状態を作り出しているともいえます。ニューロン・グリアのコミュニケーションに着目しながら、神経発達の分子基盤を明らかにすることを目指しています。
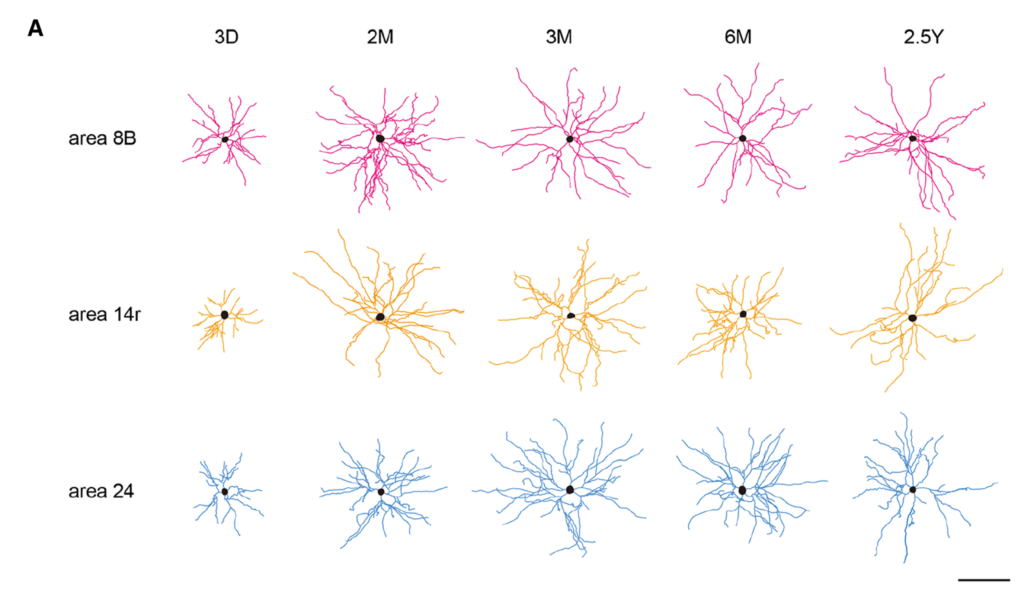
. 2015 Nov;220(6):3245-58. doi: 10.1007/s00429-014-0853-2. Epub 2014 Jul 27.
Postnatal development of dendritic structure of layer III pyramidal neurons in the medial prefrontal cortex of marmosetより抜粋。
11.Psyche -こころ- という複合的生物現象を被験者実験で捉え、その生体機序をモデル動物実験で検証する研究
この研究テーマでは「こころ」を生物現象として捉え、その発現機構の単純化メカニズムを被験者実験で推定し、それをもとに構築したモデル動物実験からその生物学的機序を解析する研究を進めています。そのため研究対象は情動反応を引き起こす自然現象や社会現象の把握から脳活動の生物学的解明にわたります。具体的には「安らぎ」や「萌え」などをキーワードに、感性の脳機能に効果がある感覚刺激の生体反応を解析します。ヒトを対象とした実験では前頭葉血流計測や自律神経反応計測などを、実験動物を対象とした実験では形態学、電気生理学、生化学、薬理学的解析を必要に応じて組み合わせて使います。そしてそれらの感覚刺激がいかにして「こころ」を構築しているのか、モノアミン作動性神経や興奮性・抑制性神経伝達などの調節に対する先天的本能に基づく反応と後天的経験に基づく反応との違いに着目して調べています。これらの研究で得られた知見が本専攻での分野横断的共同研究として社会に働きかけ、人々のQuality of Lifeの向上に寄与するものづくりに活用されることを目指しています。
12.ヒト肉眼解剖学的研究
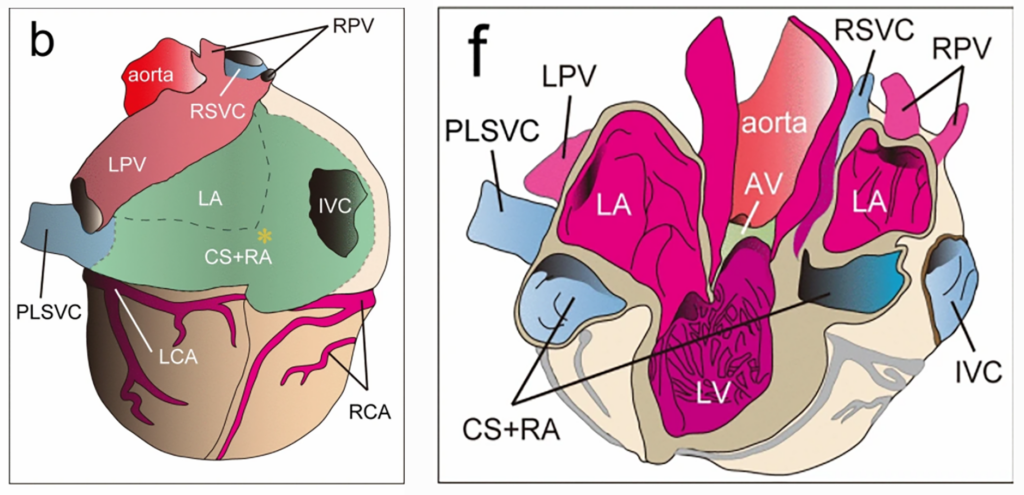
ヒトの左上大静脈遺残は古くより臨床例や研究知見が報告され続けている関心度の高い異型です 。その由来は発生期の心房斜静脈と左腕頭静脈とを連絡する静脈経路の遺残で、静脈血は斜静脈開口部より冠状静脈洞が受けます。私たちは、これまでに報告された例とは異なる外見を呈する異型について見出しました。その特徴は、左右心房壁、内腔では右心房と完全に一体化した冠状静脈洞に連続して左大静脈が繋がった構造にあり、後方に遷移した一つの心房に左右上大静脈と下大静脈が接続した外観をしていました。一方、内部構造では左大静脈と左心房、左右心房との間は心房壁が隔ており、大心静脈と中心静脈は一体化した右心房と冠状静脈洞に開口していました。
13. 長鎖遺伝子の発掘と機能解析
ヒトの遺伝子には多くの長鎖遺伝子が存在しています。長鎖遺伝子がコードする大きなタンパク質は生命活動において重要な役割を果たしており、疾患との関連性の高いものが多いと言われています。しかしながら、その大半の機能はわかっていません。増田准教授は未知の長鎖遺伝子に焦点を絞り,脳・神経系におけるそれらの遺伝子の機能解明を目指しています。増田知之准教授の研究内容の詳細は、こちらのページを見てください。
14. 神経変性疾患・神経損傷の治療を目指した基礎研究
増田准教授のグループでは、臨床系の研究室と共同でアルツハイマー病やハンチントン病といった神経変性疾患の発症機序の研究も行っています。また、脊髄損傷・末梢神経障害といった各種神経損傷に対する新しい治療法の開発を目指した基礎研究も行っています。増田知之准教授の研究内容の詳細は、こちらのページを見てください。
●研究室紹介 (解剖学・神経科学研究室)
●研究室紹介動画2022 (解剖学・神経科学研究室)

http://www.kansei.tsukuba.ac.jp/doctor/brain-science#tn

![]()